 CISTINOSI
CISTINOSICompresa : DISTURBI DEL METABOLISMO E DEL TRASPORTO DEGLI AMINOACIDI
Codici Codice esenzione : RCG040
Definizione
Disordine dell' accumulo lisosomiale dovuto ad un difetto molecolare sconosciuto, caratterizzato da diffusi depositi di cristalli di cistina nelle cellule reticoloendoteliali (Medline Thesaurus)
Segni e sintomi
I bambini con cistinosi sono normali alla nascita, ma sviluppano, di solito tra i 6 e i 12 anni di eta, segni di malattia tubulare renale di Fanconi. Questi comprendono
disidratazione, acidosi, vomito, squilibri elettrolitici, rachitismo ipofosfatemico e deficit di crescita. Il peso e proporzionato all'altezza. La circonferenza cranica e lo sviluppo intellettivo sono risparmiati dal deficit. Altre manifestazioni della cistinosi comprendono fotofobia, ipotiroidismo e riduzione della sudorazione. Il danno renale glomerulare progredisce inesorabilmente, fino a necessitare di dialisi o trapianto tra i 6 e i 12 anni di eta.
Come per la maggior parte delle malattie lisosomiali, i pazienti con cistinosi nefropatica sono del tutto normali alla nascita, eccetto forse per una pigmentazione della cute e dei capelli piu chiara dei loro fratelli. Lo sviluppo procede normalmente fino alla seconda meta del primo anno di vita, quando il lattante malato smette di crescere e di aumentare di peso, mangia poco, si mostra schizzinoso, urina e beve eccessivamente e sviluppa episodi di acidosi e disidratazione isolati o ricorrenti. Queste sono tutte manifestazioni imputabili alla sindrome tubulare renale di Fanconi.
Coinvolgimento renale
Il rene e particolarmente suscettibile agli effetti negativi dell'accumulo di cistina che si ha nella cistinosi. Il deterioramento del riassorbimento tubulare, noto come sindrome di Fanconi, e correlato con una deformita 'a collo di cigno' del tubulo contorto prossimale. La cistinosi rappresenta la piu comune causa identificabile di sindrome tubulare renale di Fanconi, benche in diagnosi differenziale possano entrare la tirosinemia, la malattia di Wilson, la sindrome di Lowe, la galattosemia e la glicogenosi. La sindrome di Fanconi causa eccesso di escrezione urinaria di glucosio, aminoacidi, fosfati, calcio, magnesio, sodio, potassio, bicarbonato, carnitina, acqua, e di indubbiamente altre piccole molecole che sono gia state identificate. Ai bambini con cistinosi inizialmente puo essere fatta una diagnosi di sindrome di Bartter, di diabete insipido o di pseudoipoaldosteronismo. Puo anche svilupparsi una proteinuria 'tubulare', in cui proteine con peso molecolare da 10 a 50 kD vengono escrete in quantita cinque volte maggiore che nel normale. L'escrezione totale di proteine puo arrivare a 5 grammi al giorno. Occasionalmente e presente ematuria microscopica. Sono stati descritti calcoli renali di urato e di ossalato di calcio, ed e stata osservata nefrocalcinosi, in associazione con una aumentata escrezione di calcio.
Nonostante i normali livelli ematici di glucosio nella cistinosi, glicosuria e poliuria possono portare alla errata diagnosi di diabete mellito giovanile. La poliuria si manifesta con una escrezione giornaliera di 2-6 litri di urine diluite (meno di 300 mOsmol/litro) e puo contribuire all'enuresi persistente o diventare minacciosa per la vita in un bambino che soffra di gastroenterite acuta. La disidratazione in un bambino del genere e rapida e puo essere accompagnata da modesta febbre cronica. L'acidosi puo essere marcata, dovuta a perdite renali di bicarbonato. Si possono verificare anche iponatriemia e ipopotassiemia, con il relativo rischio di aritmie. La debolezza muscolare dovuta all'ipopotassiemia ha condotto, in alcuni casi, ad una inappropriata biopsia muscolare. L'ipocalcemia e, occasionalmente, l'ipopotassiemia possono esitare in tetania, specialmente quando l'acidosi viene corretta acutamente con alcali. La fosfaturia porta a rachitismo ipofosfatemico con il tipico allargamento metafisario, rosario rachitico, protuberanze frontali, ginocchio valgo e difficolta a camminare. Elevati livelli sierici di fosfatasi alcalina termolabile riflettono rachitismo in fase attiva. Il metabolismo della vitamina D e normale nella cistinosi. A causa dell'aminoaciduria generalizzata, vi e una perdita media giornaliera di piu di 1 mmol/kg di 21 aminoacidi misurabili, che rappresenta una quantita di piu di dieci volte superiore alla normale escrezione di aminoacidi.
La carnitina, una piccola molecola necessaria al trasporto degli acidi grassi liberi nei mitocondri per la produzione di energia, e normalmente riassorbita per il 97%. Tuttavia, a causa della loro sindrome di Fanconi, i pazienti con cistinosi riassorbono solo il 70% di carnitina, con il risultato di un deficit di carnitina plasmatica e muscolare. Di conseguenza, si accumulano gocciole lipidiche nel muscolo, che manifesta debolezza e sviluppo scarso.
Nei pazienti non trattati il deterioramento glomerulare, che rappresenta il segno caratteristico della cistinosi, procede inesorabilmente. Dal punto di vista anatomo-patologico, il rene cistinosico mostra differenti stadi di distruzione, con trasformazione gigantocellulare dell'epitelio glomerulare, iperplasia e ipertrofia dell'apparato iuxta-glomerulare, e occasionali cellule 'scure' e inclusioni citoplasmatiche. Il risultato ultimo, comunque, e il classico rene allo stadio finale, con cicatrici e fibrosi, nefrite cronica interstiziale e degenerazione tubulare.
Accrescimento
Il ritardo di crescita rappresenta un aspetto significativo del quadro clinico della cistinosi nefropatica, anche se non comincia in utero. Lunghezza e peso sono normali alla nascita. Durante il primo anno di vita, la crescita lineare comincia a declinare. L'altezza scende al terzo percentile entro un anno di vita. Nei pazienti che non sono in terapia per ridurre la cistina, l'accrescimento e solo del 50-75% rispetto al normale, tanto che un bambino di 8 anni con cistinosi era alto come un bambino normale di 4 anni. La patogenesi del ritardo di crescita della cistinosi rimane oscura.
Danno oculare
La cistinosi danneggia la maggior parte delle strutture e delle funzioni dell'occhio, ma con un andamento variabile nella evoluzione.
Una caratteristica retinopatia periferica, con una depigmentazione a chiazze della retina e accumuli di pigmento di varia grandezza, e tipica della cistinosi nefropatica. Questa manifestazione non e presente alla nascita.
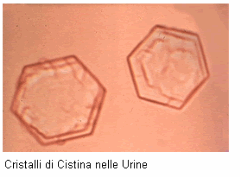
Cristalli corneali, descritti per la prima volta nel 1941, sono patognomonici della malattia quando sono osservati da oculisti esperti tramite l'esame con lampada a fessura. Cristalli fusiformi coinvolgono la porzione anteriore della cornea centrale, ma occupano l'intero spessore della cornea periferica.
La fotofobia ad esordio variabile produce un disagio di vario grado nei bambini con cistinosi, che spesso evitano la luce del sole. La fotofobia probabilmente deriva da una riflessione della luce sui cristalli corneali e congiuntivali, in quanto diminuisce dopo terapia con gocce oculari di cisteamina, ma si aggrava se non viene trattata.
La congiuntiva e l'uvea contengono cristalli birifrangenti esagonali e rettangolari, che studi di rifrazione ai raggi X hanno rivelato essere composti di L-cistina. Cio puo dare un aspetto a vetro smerigliato all'esame con lampada a fessura, ma non causa infiammazione.
I cristalli di cistina sono presenti anche nell'uvea e nella sclera dei pazienti con cistinosi.
Coinvolgimento del sistema endocrino
I bambini con cistinosi sviluppano frequentemente ipotiroidismo primario, con atrofia e formazione di cristalli nelle cellule follicolari. Cio sembra ridurre la riserva funzionale della tiroide, e causa ipotiroidismo compensato, cioe un aumento della tireotropina (TSH) prima dell'insorgenza di un franco ipotiroidismo. L'ipotiroidismo e un fenomeno correlato con l'eta. L'ipotiroidismo nella cistinosi puo essere associato a resistenza ipofisaria all'ormone tiroideo, e studi istologici di ghiandole ipofisarie cistinosiche hanno dimostrato occasionalmente iperplasia delle cellule tireotropiche e cristalli rifrangenti. Ciononostante, l'ormone della crescita, la somatomedina C e la risposta del cortisolo all'ACTH sono normali nei bambini con cistinosi.
Il pancreas puo essere interessato da un accumulo di cistina di lunga data.
Miopatia
Nonostante il muscolo sia stato a lungo considerato un tessuto non coinvolto nella cistinosi, recentemente si e reso evidente che un accumulo continuo di cistina in questo tessuto produce modifiche strutturali e deficit funzionali. Non solo i miotubuli cistinotici in coltura accumulano cistina, ma il contenuto in cistina delle biopsie muscolari aumenta con l'eta fino a valori 1000 volte superiori al normale. Le gravi difficolta alla deglutizione osservate nei pazienti piu anziani, probabilmente derivano da un deficit della funzione muscolare. Gli individui affetti hanno una ridotta forza nella lingua e nelle labbra, parola ipofonica e alterazioni della anatomia e della struttura della bocca. La gravita della disfunzione motoria della bocca aumenta con l'eta.
Il muscolo cardiaco non e stato estesamente studiato per anomalie di struttura o di funzione o per accumulo di cistina nella cistinosi.
Coinvolgimento del sistema nervoso
Benche anche il sistema nervoso sia stato considerato esente dal coinvolgimento nella malattia, questo e vero solo nelle fasi precoci della malattia. Il correlati clinici dell'accumulo di cistina nel sistema nervoso centrale comprendono atrofia cerebrale osservabile alla TAC. Nonostante cio, la maggior parte dei pazienti con cistinosi mostra un esame neurologico normale. Anche i test neurofisiologici per il sistema nervoso periferico sono normali.
Altre anomalie cliniche e di laboratorio
I pazienti caucasici (non gli ispanici o i neri) presentano una pigmentazione cutanea e dei capelli notevolmente piu chiara dei loro fratelli non affetti dalla malattia. Sono stati descritti, nei bambini con cistinosi, deficit nella memoria visiva a breve termine, nel riconoscimento tattile, nella scansione della parola e del calcolo, nonostante le valutazione del QI siano nell'intervallo di normalita. I giovani pazienti con cistinosi hanno un'intelligenza ed una performance scolastica nella media.
La maggior parte dei bambini con cistinosi nefropatica mostra un'incapacita di produrre un normale volume di sudore, che pure ha una normale concentrazione elettrolitica. La causa non e nota. Questo difetto provoca evitamento ed intolleranza al caldo, vampate, ipertermia e vomito nei bambini piu piccoli.
In un bambino con cistinosi si e verificata ipertermia intraoperatoria, e sono comuni problemi di alimentazione. Polineuropatia e fibrosi polmonare sono state descritte in pazienti dopo il trapianto di rene.
Non vi sono dati che i pazienti eterozigoti per la cistinosi abbiano cristalli di cistina in qualche tessuto o cellula, o manifestino qualche segno clinico della sindrome renale di Fanconi.
Sono due i fenotipi principali della cistinosi: nefropatico e non-nefropatico.
Nella forma ad esordio tardivo della cistinosi nefropatica, l'eta di presentazione va dai 2 ai 26 anni, ed e, di solito, simile tra fratelli o tra membri affetti della stessa famiglia. L'eta di presentazione piu comune e tra i 12 e i 15 anni. I pazienti con malattia ad esordio tardivo spesso non sviluppano una sindrome di Fanconi completa, ma la malattia renale puo progredire fino allo stadio finale entro pochi anni dalla diagnosi.
Altri pazienti hanno una forma di cistinosi detta benigna, o oculare o non-nefropatica, che di solito viene scoperta accidentalmente quando un esame oftalmologico rivela opacita cristalline in cornea e congiuntiva. Questi pazienti possono lamentare fotofobia simile a quella dei pazienti con forma nefropatica, ma e una fotofobia che non si sviluppa mai prima della mezza eta e che di solito non e disabilitante.
I pazienti con cistinosi oculare presentano depositi cristallini nel midollo osseo ed elevati livelli di cistina nei leucociti, ma non sviluppano mai malattia renale. Essi hanno una normale spettanza di vita, ma, poiche alcuni pazienti con cistinosi ad esordio tardivo non sviluppano disfunzione renale prima dei 20-25 anni, i pazienti con presunta cistinosi oculare dovrebbero essere seguiti con attenzione (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Storia naturale
Il decorso clinico e la gravita dell'accumulo di cistina nella cistinosi varia, in famiglie diverse, da una cistinosi oculare in adulti con cristalli corneali, ma senza malattia renale, a una cistinosi intermedia in adolescenti con deterioramento renale ad esordio tardivo, alla classica cistinosi nefropatica del lattante.
Gli eterozigoti, in tutti i tipi di cistinosi, sono clinicamente normali.
La storia naturale della cistinosi dopo la prima infanzia permette di affermare che i bambini malati avranno uno sviluppo intellettivo normale, ma continueranno ad avere una crescita scarsa. La funzione glomerulare renale si deteriora gradualmente, richiedendo trapianto renale intorno ai 9-10 anni di eta.
Questi bambini avranno predisposizione alle infezioni, nonostante nei fagociti dei bambini con cistinosi siano state descritte alterazioni della motilita e dell'adesivita ed aumento dei livelli di leucotriene C4. Dopo il trapianto di rene, la funzione renale si normalizza. L'accrescimento e la statura finale nei pazienti con cistinosi dopo il trapianto di rene e estremamente variabile.
Dopo l'avvento del trapianto di rene, la cistinosi, da una malattia mortale in infanzia quale era, seguita da nefrologi pediatri, e diventata una malattia dell'adulto che rappresenta una sfida per internisti ed altri specialisti (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Eziologia
Il gene per la cistinosi, CTNS, e localizzato nel cromosoma 17p13, ha 12 esoni che si estendono in 23 kb di DNA genomico, e codifica per una proteina di 367 aminoacidi chiamata cistinosina, con 7 domini transmembrana e 8 potenziali siti di glicosilazione. Circa il 40% dei pazienti con cistinosi del nord Europa e omozigote per una delezione di 57 kb che rompe il gene CTNS. Il 12% dei 216 alleli di una popolazione americana di affetti da cistinosi contiene una mutazione 753G ? A (W138X). Sono state identificate altre 29 mutazioni (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
INCIDENZA
Nel Nord America, l'incidenza di cistinosi nefropatica infantile e di circa 1:100.000/1:200.000 nati vivi, con una prevalenza dei portatori di circa 1:200 nella popolazione generale. L'incidenza e piu alta in talune sottopopolazioni. Nella provincia francese della Bretagna, ad esempio, l'incidenza stimata e di 1:26.000, mentre nel resto della Francia l'incidenza e di 1:326.440 (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Diagnosi
L'eta alla diagnosi si abbassa continuamente, con il crescere della consapevolezza dei medici, ma alcuni bambini ancora probabilmente sfuggono alla diagnosi perche muoiono per disidratazione durante un episodio acuto di diarrea. In una famiglia, il primo individuo diagnosticato arriva alla diagnosi di cistinosi nefropatica per il sospetto di anomalie renali. La diagnosi e confermata dal dosaggio del contenuto di cistina nei globuli bianchi.
La cistinosi puo essere diagnosticata direttamente, nei bambini con piu di 1 anno di eta, con l'esame oftalmologico, usando la lampada a fessura, che rivela la tipica cheratopatia del cristallino. La diagnosi puo essere fatta anche tramite l'esame dell'aspirato midollare con microscopio a fase, dove i cristalli di cistina diventano visibili alla luce polarizzata. In linea generale, tuttavia, ai pazienti dovrebbero venir risparmiate, se possibile, biopsie ed aspirazioni invasive.
Non c'e un programma di screening per la cistinosi, per via della natura indaginosa dei test diagnostici correntemente in uso (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Diagnosi prenatale e prevenzione
La cistinosi puo essere diagnosticata in utero tramite il dosaggio della cistina negli amniociti o nei villi coriali, o alla nascita tramite il dosaggio della cistina nella placenta.
Visto il successo della terapia con cisteamina, molte famiglie adesso rifiutano la diagnosi prenatale, ma chiedono che la diagnosi venga posta immediatamente alla nascita, in modo tale che il trattamento con cisteamina bitartrato possa cominciare il piu presto possibile. Cio e possibile misurando il contenuto di cistina della placenta e/o dei leucociti ottenuti da sangue del cordone ombelicale. Per una diagnosi precoce sono disponibili anche tecniche di diagnosi dal DNA (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Terapia
Sintomatica
I bambini con cistinosi hanno poliuria estrema secondaria al danno tubulare renale, per cui e essenziale che possano aver libero accesso a grandi quantita di acqua, giorno e notte. Le perdite urinarie di bicarbonati ed elettroliti vanno rimpiazzate per via orale. Perdite urinarie progressive di fosfati conducono a rachitismo, e di solito necessitano di introduzione orale di fosfati, con supplementazione di vitamina D, che ne aumenta l'assorbimento intestinale.
Molti centri europei trovano l'indometacina di grande aiuto nella gestione dei bambini con cistinosi. Usata correttamente, riduce marcatamente le perdite urinarie abnormi e, limitando la necessita di bere acqua, puo aumentare l'appetito e favorire l'accrescimento. Le dosi di indometacina (2-3 gr/kg/die) sono calibrate su ciascun paziente n modo tale da non diminuire il tasso di filtrazione glomerulare. Il meccanismo d'azione dell'indometacina e legato all'inibizione della sintesi delle prostaglandine.
Il deficit di carnitina dovuto alla sindrome di Fanconi puo essere trattato con sostituzione orale di L-carnitina.
Trapianto di rene
Poiche l'anomalia di base che porta all'insufficienza renale e un difetto dell'ambiente intracellulare geneticamente determinato, le cellule senza il difetto genetico che vengono trapiantate in un paziente con cistinosi non accumulano cistina intralisosomiale. Questa consapevolezza, e il successo della procedura, hanno portato ad un diffuso utilizzo del trapianto nei pazienti con cistinosi. Anzi, il trapianto di rene, nei pazienti con cistinosi, ha maggior successo che nei bambini con altre malattie renali croniche.
Terapia specifica per ridurre l'accumulo di cistina
Terapia con cisteamina orale: la cisteamina (beta-mercaptoetilamina) e stata molto efficace nel rimuovere la cistina dalle cellule cistinotiche e nella protezione degli organi dai danni progressivi. Nel 1994 la Food and Drug Administration americana ha approvato le capsule di cisteamina bitartrato (Cystagon) per la terapia della cistinosi.
Gocce oculari di cisteamina: nonostante anni di terapia orale con cisteamina, i bambini con cistinosi continuano ad accumulare cristalli corneali, che provocano erosioni ed ulcerazioni dolorose nei pazienti piu grandi. Dopo dimostrazione della sicurezza delle gocce di cisteamina in occhio di coniglio, due pazienti con cistinosi di eta inferiore ai 2 anni sono stati arruolati in un trial clinico randomizzato in doppio cieco, che utilizzava placebo (soluzione salina) per un occhio e cisteamina allo 0.1% piu soluzione salina nell'altro occhio, con il risultato di una marcata riduzione dei cristalli corneali nell'occhio trattato, dopo 4-5 mesi di terapia. Attualmente, piu di 100 pazienti sono sotto protocollo, e non ci sono stati effetti collaterali imputabili a questa terapia. Al momento presente, la FDA americana non ha approvato alcuna formulazione di gocce oculari di cisteamina.
Uso dell'ormone della crescita
L'efficacia a lungo termine dell'ormone della crescita umano ricombinante nella bassa statura dei pazienti con malattia renale cronica e riconosciuta. Il gruppo di studio europeo sulla terapia con ormone della crescita dei bambini con bassa statura affetti da cistinosi nefropatica ha portato a termine uno studio su 36 pazienti con cistinosi. Ha trovato un eccellente aumento della velocita di crescita (piu che raddoppiata), e nessuna accelerazione nel declino della funzione renale. Questo studio ha anche fornito ulteriori evidenze che la terapia con cisteamina riduce la progressione dell'insufficienza renale nella cistinosi (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Eighth Edition).
Bibliografia
McCarty-MF
Inhibition of acetyl-CoA carboxylase by cystamine may mediate the hypotriglyceridemic activity of pantethine
Medical-Hypotheses. Mar 2001; 56 (3) : 314-317
Cherqui-S; Kalatzis-V; Trugnan-G; Antignac-C
The targeting of cystinosin to the lysosomal membrane requires a tyrosine-based signal and a novel sorting motif
Journal-Of-Biological-Chemistry. Apr 20 2001; 276 (16) : 13314-13321
Zhai-YF; Heijne-WHM; Smith-DW; Saier-MH
Homologues of archaeal rhodopsins in plants, animals and fungi: structural and functional predications for a putative fungal chaperone protein
Biochimica-Et-Biophysica-Acta-Biomembranes. Apr 2 2001; 1511 (2) : 206-223
Madani-K; Otoukesh-H; Rastegar-A; Van-Why-S
Chronic renal failure in Iranian children
Pediatric-Nephrology. Feb 2001; 16 (2) : 140-144
Langlois-V; Geary-D; Murray-L; Champoux-S; Hebert-D; Goodyer-P
Polyuria and proteinuria in cystinosis have no impact on renal transplantation - A report of the North American Pediatric Renal Transplant Cooperative Study (vol 15, pg 7, 2000)
Pediatric-Nephrology. Feb 2001; 16 (2) : 201
Anikster-Y; Lacbawan-F; Brantly-M; Gochuico-BL; Avila-NA; Travis-W; Gahl-WA
Pulmonary dysfunction in adults with nephropathic cystinosis
Chest-. Feb 2001; 119 (2) : 394-401
Busuttil-DP; Yin-JAL
The bone marrow in hereditary cystinosis
British-Journal-Of-Haematology. Nov 2000; 111 (2) : 385
Mungan-N; Nischal-KK; Heon-E; MacKeen-L; Balfe-JW; Levin-AV
Ultrasound biomicroscopy of the eye in cystinosis.
Arch-Ophthalmol. 2000 Oct; 118(10): 1329-33
Fonte: http://malattierare.regione.veneto.it

Nessun commento:
Posta un commento