L’espressione “diabete mellito” si riferisce ad un gruppo di malattie che hanno in comune l’alterazione del metabolismo del glucosio. Il termine “diabete” vuol dire passare attraverso e indica il passaggio di glucosio nelle urine da cui “mellito”.
Il diabete mellito è una condizione assai diffusa che colpisce circa il 3 - 5% della popolazione mondiale, è perciò una malattia sociale che comporta gravi conseguenze invalidanti:
- Conseguenze acute e croniche
- Uno dei principali fattori di rischio cardiovascolare
- La malattia inizialmente è asintomatica per cui il paziente spesso non sa di essere diabetico e altrettanto spesso non si cura
DIABETE MELLITO TIPO 1
(detto autoimmune, giovanile o magro, 5% di tutte le forme di diabete)
DIABETE MELLITO TIPO 2
(eziologia ignota, fattori genetici ed ambientali, grasso, 90% di tutte le forme)
Diabete mellito dovuto a:
- Malattie del pancreas (pancreatiti, carcinoma ecc...)
- Endocrinopatie (sindrome di Cushing, feocromocitoma, acromegalia)
- Iatrogeno (cortisonici, ecc.)
- Difetti recettoriali
- Sindromi genetiche (lipodistrofia)
(insorgente nel 2°-3° trimestre di gravidanza)
SCALA DEI VALORI PER LA DIAGNOSI
Valore di glicemia normale a digiuno: < 110mg/100ml.
Valore di glicemia alterato a digiuno: 110 – 125mg/100 ml.
Per digiuno si intende l’assenza di apporto calorico da almeno 8 ore.
CRITERI DIAGNOSTICI
- Poliuria, polidipsia ed altre manifestazioni acute di iperglicemia con glicemia ≥ 100mg/100ml
- Glicemia a digiuno > 125mg/100ml confermata dalla ripetizione dell’esame in un giorno successivo
- Glicemia ≥ 100mg/100ml 2 ore dopo l’esame della curva da carico orale di glucosio confermata dalla ripetizione dell’esame un giorno successivo (questo metodo non è consigliabile nella pratica clinica di routine).
Oggi la più semplice esecuzione di altre tecniche diagnostiche permette di esaminare un numero molto più elevato di pazienti.
INSULINA
Le cellule endocrine del pancreas sono principalmente:
Cellule β:
- Producono insulina
- Sono il 60% di tutte le cellule endocrine del pancreas
- Producono il glucagone
- Sono il 25% delle cellule
La sintesi dell’insulina, come tutte le proteine, avviene nei ribosomi. L’insulina deriva dalla pro-insulina, costituita da catene α, β e dal polipeptide-C. Nell’attivazione dell’insulina il polipeptide-C si scinde liberando insulina, peptide-C (in concentrazioni equimolecolari) e tracce di proinsulina.
L’insulina ha emivita di 4,8min, il peptide-C 30min, pertanto il rapporto peptide-C/insulina ematico è 3:1 – 5:1. Il dosaggio del peptide-C ematico di un paziente diabetico trattato con insulina indica l’attività residua delle cellule β. Tale dosaggio permette di valutare se il paziente trattato con insulina può passare agli antidiabetici orali (sempre nel DMT2).
FISIOLOGIA DELLA RISPOSTA SECRETORIA INSULINICA

La risposta insulinica al glucosio si verifica in due fasi:
- Risposta rapida
Insufficiente nel DMT2, assente nel DMT1)
- Risposta lenta

L’euglicemia è mantenuta nell’organismo attraverso un equilibrio di antagonisti biologici che si bilanciano a vicenda.

DIABETE MELLITO TIPO 1 (DMT1) (DETTO ANCHE GIOVANILE O MAGRO)
Il DMT1 colpisce soprattutto nella fascia di età inferiore ai 20 anni (picco tra i 10 e i 14 anni) con incidenze simili tra maschi e femmine e distribuzione varia in tutto il mondo (più alta in Finlandia, più bassa in Messico).
 Il DMT1 è caratterizzato dalla riduzione assoluta della concentrazione di insulina sia basale che dopo stimolo da iperglicemia, pertanto il glucosio entra con difficoltà nelle cellule bersaglio, in particolare quelle muscolari, accumulandosi nel sangue (iperglicemia).
Il DMT1 è caratterizzato dalla riduzione assoluta della concentrazione di insulina sia basale che dopo stimolo da iperglicemia, pertanto il glucosio entra con difficoltà nelle cellule bersaglio, in particolare quelle muscolari, accumulandosi nel sangue (iperglicemia). EZIOLOGIA
Il DMT1 nasce con la distruzione selettiva delle cellule β del pancreas (più dell’80% del totale). Questa azione è mediata dal sistema immunitario per cui si parla di processo autoimmune che determina un’insulite comportando una riduzione assoluta della sintesi di insulina e la dipendenza dalla terapia sostitutiva con insulina esogena. In un piccolo numero di casi di DMT1 il meccanismo autoimmune è assente e l’eziologia è ancora più oscura (si parla di DMT1 idiopatico).

Le isole sono attaccate dal sistema immunitario (linfociti NK, linfociti T citotossici – cd8+), ma solo nelle fasi iniziali, infatti dopo qualche anno dall’esordio questo quadro acuto scompare. Il pancreas diviene povero di cellule β (ridotte al 10% e sostituite da tessuto fibroso). Questo perché l’antigene stimolante il processo autoimmune si trova sulle cellule β.
Gli auto-anticorpi possono essere di vario tipo:
- Anticorpi anti-insulina
- Anticorpi anti-proinsulina
- Anticorpi anti-GAD (decarbossilasi dell’acido glutammico)
Trattando con insulina il DMT1 ad esordio improvviso si ha una ripresa della capacità del pancreas di produrre insulina endogena (come dimostrato dalla secrezione del peptide-C che raggiunge il massimo dopo 2-6 mesi). Spesso per alcuni anni si ha completa normalizzazione dell’attività del pancreas (fenomeno della luna di miele).
FISIOPATOLOGIA
La carenza totale di insulina causa iperglicemia che se supera 180mg/100ml di concentrazione, oltrepassa la soglia renale del riassorbimento del glucosio, entrando nelle urine (glicosuria). Infatti nel rene normalmente il glucosio viene filtrato e riassorbito per il 95% dal tubulo contorto prossimale. La glicosuria a sua volta provoca poliuria (osmosi) che se non compensata da un aumento dell’introduzione d’acqua (il senso di sete determina polidipsia) causa disidratazione. La diminuita utilizzazione del glucosio provoca dimagrimento, astenia ed aumento dell’appetito con conseguente polifagia.
DIABETE MELLITO TIPO 2 (DMT2)
Il DMT2 rappresenta circa l’85% dei casi totali di diabete colpendo in genere pazienti di età superiore a 30 anni. In questo caso non si parla di processo autoimmune, ma di una serie di fattori di rischio che si trasmettono in modo poligenico (si parla di predisposizione alla malattia). Si capisce quale importanza hanno i fattori genetici (a differenza del DMT1) escludendo l’associazione con l’HLA, infatti le cellule β sono generalmente conservate, ma si denota una certa amiloidosi nelle isole pancreatiche.
MODALITÀ DI ESORDIO O SCOPERTA
Per le caratteristiche stesse del diabete (asintomatiche) i pazienti non sanno di avere la malattia e spesso non la curano in modo adeguato. Generalmente ci si accorge di essere diabetici in modo occasionale (iperglicemia asintomatica) o nel momento in cui si mostrano i sintomi (iperglicemia sintomatica, sindrome iperglicemica iperosmolare, complicanze microvascolari e macrovascolari, nefropatia, neuropatia, ulcere nei piedi, infezioni cutanee).
FISIOPATOLOGIA
L’insulina basale a digiuno può essere ridotta, normale o aumentata, ma vi è sempre una riduzione della risposta secretoria precoce all’iperglicemia con valori d’insulinemia che rispecchiano diverse fasi della malattia:
- Glicemia normale ed insulinemia aumentata
- Glicemia aumentata ed insulinemia aumentata
- Glicemia aumentata ed insulinemia diminuita
I meccanismi di disturbo della la normale fisiologia dell’insulina possono perciò agire prima che avvenga il legame con il recettore (azione pre-recettoriale – insulina alterata geneticamente o anticorpi anti-insulina), durante il legame con il recettore (azione recettoriale – anticorpi anti-recettore, riduzione del numero dei recettori, alterazioni strutturali del recettore) o possono disturbare il meccanismi intracellulari di attivazione del metabolismo del glucosio (azione post-recettoriale – anomalie dei meccanismi di trasmissione del segnale all’interno della cellula).
Nel DMT2 dunque vi è spesso insulinoresistenza, ma molti pazienti pur avendola non sviluppano il diabete, ciò significa che in queste persone l’aumento d’insulinemia permette valori normali della glicemia (insulinoresistenza determina iperinsulinemia). Questa condizione è però anche causa di obesità (causa a sua volta insulinoresistenza), ipertensione arteriosa, iperlipemia e coronaropatie.
L’obesità è frequente nel DMT2 (BMI > 22) perché l’associazione di iperinsulinismo e insulinoresistenza, soprattutto nei diabetici obesi, hanno come effetto la necessità di una maggiore quantità d’insulina per controllare la glicemia. La riduzione del peso determina il miglioramento del DMT2.
LA CLINICA DEL DIABETE MELLITO
La clinica del DMT si identifica spesso con le sue complicanze. Circa il 20% dei diabetici al momento della diagnosi hanno le complicanze del diabete il che significa che ampi danni strutturali si sviluppano durante la fase asintomatica preclinica (trascorrono in genere 10 anni tra l’insorgenza dell’iperglicemia e la diagnosi clinica di diabete). Il trattamento precoce dell’iperglicemia è più efficace e perciò si effettua uno screening in tutti i soggetti di età > 45 anni e nei soggetti di età < a 45 anni che però presentano i vari fattori di rischio:
- Familiarità
- Peso alla nascita > 4kg
- Obesità
- Trigliceridi > 250mg/100ml
- Colesterolo HDL < 35mg/100ml
- Precedente alterata glicemia a digiuno
- Sindrome dell’ovaio policistico
- Ipertensione arteriosa
- Precedente DMG
Alterazione generalizzata presente sia nel DMT1 che nel DMT2 consistente in un ispessimento della membrana basale dei piccoli vasi. La maggior parte delle complicanze microvascolari può essere prevenuta, ritardata o anche fatta regredire mediante uno stretto controllo della glicemia sia a digiuno, sia postprandiale (con livelli normali). Gli organi più colpiti sono la retina e il rene.
MALATTIA DIABETICA OCULARE
Nella microangiopatia della retina si possono avere retinopatie (retinopatia non proliferativa e proliferativa), cataratta e glaucoma .
La retinopatia si distingue in 2 tipi:
- Retinopatia diabetica non proliferativa (NPDR) – meno grave, non presenta proliferazioni vascolari, ma presenta microaneurismi soprattutto all’interno della macula, emorragie, venule a corona di rosario, essudati ed edema maculare.
- Retinopatia diabetica proliferativa (PDR): più grave, presenta proliferazioni fibrovascolari che crescono dalla retina all’interno del corpo vitreo. Mentre il danno della retinopatia non proliferativa è limitato alla retina, quello della forma proliferativa di estende al corpo vitreo.
Il rene è colpito in circa 1/3 dei casi di DMT1 e meno nel DMT2 e non vi è predisposizione genetica alla nefropatia diabetica (il rene di donatore sano trapiantato al diabetico ben controllato non si ammala).
Le patologie più diffuse delle vie urinarie nel diabetico:
- La glomerulopatia
- La pielonefrite, infezione delle vie urinarie superiori (bacinetto e calici)
- La necrosi papillare
- La cistite
Clinicamente la nefropatia diabetica può decorrere in maniera silente fino all’insufficienza renale cronica. I sintomi e la decorrenza nel tempo:
- Microalbuminuria (30 – 300mg/die)
- Proteinuria (> 300mg/die) con eventuale sindrome nefrosica (> 3gr/die)
- Insufficienza renale cronica (aumento della creatinina e dell’azotemia)
- Uremia terminale
Ha una frequenza assai diversa tra i vari studi variando dal 5 al 50% dei casi di diabete a seconda dei criteri usati per definirli.
La classificazione delle neuropatie diabetiche:
- Polineuropatia
- Mononeuropatia dei nervi cranici
- Mononeuropatia dei nervi ulnare, mediano, femorale e sciatico
- Multineuropatia dei nervi cranici
- Radicolopatia toracica
La polineuropatia è cronica ed esordisce in modo insidioso. Colpisce le fibre sensitivo-motorie (prevalentemente sensitiva) degli arti, soprattutto quelli inferiori, in modo simmetrico. Il dolore da sordo diventa acuto, trafittivo, urente e lancinante, accompagnato a iperalgesia cutanea, tanto che il paziente non riesce a tollerare il contatto con le lenzuola.
Spesso il paziente avverte dolore alla palpazione dei polpacci, ipoestesia ai piedi causa delle ulcere (nei casi più gravi c’è perdita della sensibilità dolorifica), non presenta o è ridotta la sensibilità vibratoria, soprattutto al piede e spesso il riflesso rotuleo è presente mentre l’Achilleo è assente.
Le parestesie sono:
- Intorpidimento
- Formicolio
- Senso di freddo
Nelle mononeuropatia e nelle multineuropatie si ha prevalentemente l’interessamento delle fibre motorie rispetto a quelle sensitive. Queste hanno un esordio acuto, dolori intensi e colpiscono spesso i nervi oculomotori, ulnare, radiale e femorale.
NEUROPATIA VEGETATIVA NEL DIABETICO
Il SNA esercita funzioni di regolazione su diversi organi ed apparati, come l’apparato cardiovascolare, gastroenterico, genitale, respiratorio e le ghiandole.
La neuropatia vegetativa colpisce questo sistema in particolar modo viene colpito più precocemente il parasimpatico che il simpatico.
Vi è una certa irregolarità nella distribuzione delle lesioni in uno stesso individuo, in genere le manifestazioni cliniche della neuropatia vegetativa compaiono dopo quelle della neuropatia periferica, ma ciò non è la regola.
Principali apparati interessati:
- Cardiovascolare
- Tachicardia
- Perdita del dolore ischemico
- Ipotensione ortostatica
- Respiratorio
- Alterato controllo dell’attività respiratoria
- Gastroenterico
- Disfunzione esofagea
- Gastroparesi
- Disturbi dell’alvo
- Genitourinario
- Eiaculazione retrograda
- Impotenza sessuale
- Atonia vescicale
- Esocrino
- Anidrosi degli arti inferiori
- Sudorazione da stimolazione gustativa
Avendo il danno prima del parasimpatico e poi del simpatico si arriva ad avere una frequenza cardiaca fissa per cui i pazienti presentano spesso tachicardia (intorno a 110/min in quanto la compressione del seno carotideo non riduce la frequenza) e perdita della variazione ciclica della frequenza cioè l’aritmia sinusale respiratoria (normalmente la frequenza varia in relazione agli atti respiratori, aumenta durante l’inspirazione e diminuisce durante l’espirazione).
PERDITA DEL DOLORE ISCHEMICO
Nel diabetico vi è una maggiore frequenza di infarto silente per lesione delle fibre dolorifere che decorrono assieme a quelle simpatiche.
IPOTENSIONE ORTOSTATICA
Consiste in una caduta della PA sistolica > 30mmhg nel passaggio dalla posizione clinostatica a quella ortostatica, perdurante per 1-2 minuti. Per essere sintomatica, la caduta della PA sistolica deve essere > 60-70mmhg. I sintomi sono la sensazione di testa vuota, perdita momentanea della vista e la perdita di conoscenza.
L’ipotensione ortostatica può essere scambiata con una crisi ipoglicemica, ma a differenza di questa, regredisce col ritorno alla posizione clinostatica. Si evidenzia con l’uso di diuretici, ipotensivi o psicofarmaci. Può scomparire in seguito al manifestarsi di una sindrome nefrosica o di uno scompenso cardiaco.
MANIFESTAZIONI A CARICO DELL’APPARATO GASTROENTERICO
ESOFAGO
Le manifestazioni a carico dell’esofago consistono in una modica dilatazione, la riduzione della peristalsi con rallentamento del transito di alimenti, ipotonicità dello sfintere cardiale e conseguente reflusso gastro-esofageo. Raramente si manifesta la pirosi perché l’associata lesione dell’innervazione gastrica comporta una riduzione dell’acidità.
STOMACO
Le manifestazioni a carico dello stomaco consistono nella gastroparesi con cospicua dilatazione dello stomaco fino a tre volte le dimensioni normali (soprattutto dopo i pasti) dunque peristalsi torpida con svuotamento lento, singhiozzo e anoressia. Le ipoglicemie apparentemente inspiegabili sono in realtà dovute al fatto che la somministrazione dell’insulina avviene come se il paziente fosse a digiuno. Sarà importante seguire una dieta con pasti frazionati.
INTESTINO TENUE
Le manifestazioni a carico dell’intestino tenue consistono nella diarrea (più frequente di notte e dopo i pasti) abbondante ed acquosa, incontinenza fecale e non tenesmo.
COLON
Le manifestazioni a carico del colon consistono nella stipsi e talvolta megacolon
LA CUTE NEL DIABETE
Il trofismo cutaneo è ridotto in molti diabetici (cute secca, ipoelastica, sottile, desquamante, peli scarsi, alopecia, unghie sottili e fragili) e le infezioni sono più frequenti e durature perché vi è una ridotta capacità a difendersi da esse (leucociti spesso disfunzionali). La candidosi dei genitali, delle pieghe e delle unghie dovrebbe far sospettare un diabete non ancora diagnosticato. Il prurito generalizzato è spesso presente e può essere dovuto a cause varie tra cui la neuropatia periferica e l’insufficienza renale. Il prurito localizzato, invece, può far sospettare una candida albicans.
IL PIEDE DIABETICO
Le alterazioni del piede nel diabetico sono la conseguenza soprattutto di complicanze vascolari (arteriopatia obliterante degli arti inferiori, ulcere vascolari), neuropatie periferiche (nei casi più gravi perdita della sensibilità dolorifica ed ulcera neuropatica) e cause infettive.



 Tutto ciò può portare ai quadri disastrosi dell’osteoartropatia neurogena (cosiddetta articolazione di Charcot). Nella osteoartropatia neurogena il piede gradualmente diviene rigonfio, senza che vi sia riconoscibile accumulo di liquido o infiammazione, assumendo un aspetto tozzo con appiattimento dell’arco longitudinale e tendenza alla rotazione esterna del piede stesso. Radiologicamente si ha lisi ossea, frammentazione, eburneizzazione, disarticolazione delle ossa del piede. L’articolazione di Charcot si può rilevare non solo nel diabete ma anche in altre malattie in cui viene meno la componente sensitiva e rimane conservata quella motoria.
Tutto ciò può portare ai quadri disastrosi dell’osteoartropatia neurogena (cosiddetta articolazione di Charcot). Nella osteoartropatia neurogena il piede gradualmente diviene rigonfio, senza che vi sia riconoscibile accumulo di liquido o infiammazione, assumendo un aspetto tozzo con appiattimento dell’arco longitudinale e tendenza alla rotazione esterna del piede stesso. Radiologicamente si ha lisi ossea, frammentazione, eburneizzazione, disarticolazione delle ossa del piede. L’articolazione di Charcot si può rilevare non solo nel diabete ma anche in altre malattie in cui viene meno la componente sensitiva e rimane conservata quella motoria. 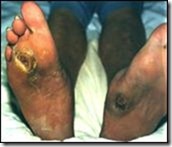
ULCERA PLANTARE
Risultato di microtraumi e ripetuti stimoli meccanici su un piede che ha perso la normale innervazione sensitiva. Queste ulcere possono facilmente infettarsi.
IL PIEDE DIABETICO: CLINICA E PREVENZIONE
All’ispezione, il piede rivela spesso l’assenza di peluria con cute liscia (dovuto alla perdita della funzione autonoma), la presenza di callosità, ulcere e deformazioni. Il piede non sempre è freddo, ma può essere anche molto caldo.
Il paziente diabetico deve:
- Controllare il piede ogni sera con l’aiuto di uno specchio (per la pianta) o farselo controllare
- Curare scrupolosamente l’igiene del piede, soprattutto nelle pieghe interdigitali, asciugandolo accuratamente
- L’acqua deve essere tiepida e la temperatura controllata con la mano (mai col piede) o farsela controllare da altra persona
- Mai tagliare in profondità le unghie
- Usare tronchetti, non forbici
- Eliminare i calli
- Usare calze bianche
- Usare scarpe con tomaia senza cuciture e comoda, non stretta alle punte
- Evitare i tacchi alti
- Interporre un’imbottitura tra piede e scarpa per prevenire la abrasioni
- Mai andare a piedi nudi, nemmeno in casa, tanto meno sulla sabbia
Molto più frequente nel DMT1 (30% dei casi) ed é rara nel DMT2 é più frequente nei mesi freddi (per la maggiore possibilità di infezioni) può essere la manifestazione dell’esordio clinico del DMT1 fino ad allora sconosciuto.
Le cause scatenanti possono essere infezioni urinarie, infezioni respiratorie
colecistite, pancreatine, ictus cerebrale, infarto del miocardio, ipertiroidismo, feocromocitoma, gravidanza, stress psichici, interventi chirurgici non preparati con la terapia insulinica e terapia steroidea incongrua.
FISIOPATOLOGIA
L’ossidazione totale di una molecola di glucosio produce 6 molecole di CO2 e 6 molecole di H2O.


Sia la beta ossidazione degli acidi grassi che l’ossidazione dell’acido piruvico portano all’Acetil-coenzima-A CH3-CO-S (AcetilCoA).
CHETOGENESI
Nella beta ossidazione non viene prodotto Acido Piruvico, quindi mancando la glicolisi, manca l’acido Ossalacetico. L’AcetilCoA dunque non viene inserito nel ciclo di Krebs con conseguente sovrapproduzione di AcetilCoA e formazione di corpi chetonici.

MECCANISMI ORMONALI
La chetogenesi nella CAD è dovuta a carenza di insulina e ad incremento del glucagone. L’insulina stimola la glicogenosintesi e inibisce la gliconeogenesi, glicogenolisi, lipolisi, chetogenesi e il glucagone stimola la beta ossidazione (aumenta la carnitina acetil-transferasi I che permette il trasporto degli acidi grassi all’interno dei mitocondri dove risiedono gli ormoni della beta ossidazione).
SINTOMATOLOGIA
Anoressia, nausea, vomito, poliuria, si possono avere alterazioni della coscienza e coma, raramente si ha collasso o insufficienza renale acuta.
Nella chetoacidosi la temperatura corporea è normale o bassa, per cui la febbre è segno di infezioni, ma anche in caso di infezioni la febbre può mancare. Vi può essere dispnea, cute secca, globi oculari ipotonici, lingua arida con ragadi laterali, alito acetonico (frutta matura).
La leucocitosi, anche marcata, è una caratteristica della CAD, non un segno di infezione
ASPETTI CLINICI
Si ha il rapido e progressivo peggioramento di una sintomatologia strettamente diabetica: poliuria, polidipsia, astenia, dimagrimento, disturbi gastroenterici, raro il coma, respiro di Kusmaul (rapido e profondo per l’acidosi), alito acetonico, disidratazione, ipotensione, tachicardia.
LABORATORIO
- Leucocitosi
- Emoconcentrazione
- Ipersodiemia
- Ipopotassiemia
- Ipopiastrinemia
- Acidemia
- Ipobicarbonatemia
- Ipertrigliceridemia
- Glicosuria
Il glucosio non riassorbito ostacola il riassorbimento di acqua e Na+ (diuresi osmotica) determinando poliuria e perdita di Na+ e K+, quindi disidratazione iposodiemica ed ipokaliemica.
ACIDOSI
Il pH normale del sangue arterioso è 7,4, esso è dovuto ad un equilibrio tra le sostanze acide e basiche (sistemi tampone) dei quali il più importante è il sistema tampone bicarbonato/acido carbonico (HCO3-/H2CO3).

L’acidosi scompensata comporta un abbassamento del pH ematico (acidemia) essa, in termini generali, può essere dovuta o ad abbassamento del bicarbonato (acidosi metabolica) o ad aumento dell’acido carbonico (acidosi respiratoria). Nella CAD abbiamo acidosi metabolica per il consumo del bicarbonato che serve a tamponare i chetoacidi, quindi il pH si abbassa (acidosi metabolica con acidemia o scompensata). Il compenso avviene ad opera dei polmoni con iperventilazione.
TERAPIA
Idratazione 3-5 litri di acqua (questi pazienti possono perdere liquidi fino al 10% del peso corporeo), trattandosi di una disidratazione iperosmolare sarebbe giusto infondere soluzioni ipotoniche (allo 0,45%), ma una soluzione isotonica (0,9%) è più efficace nell’espandere nuovamente il volume extracellulare, per cui si preferisce iniziare con soluzioni isotoniche (soluzione fisiologica) anche perché nella 1a ora è necessario somministrare circa un litro di acqua e l’uso di soluzioni ipotoniche potrebbe determinare una troppo rapida caduta dell’osmolarità con possibile edema cellulare, soprattutto cerebrale.
L’idratazione può di per sé abbassare la glicemia favorendo l’entrata di glucosio nelle cellule. Quando la glicemia scende al di sotto di 300mg/100ml si può infondere soluzione glucosata al 5% che agisce come fonte di acqua libera prevenendo l’edema cerebrale tardivo. La CAD non può essere curata senza insulina. L’ipopotassiemia è la principale causa di morte nella CAD non complicata perciò l’infusione di K+ va iniziata subito anche se i valori della potassiemia sono normali perché con la terapia insulinica il K+ tende a scendere entrando nelle cellule. La correzione dell’acidosi fa rientrare il K+ nelle cellule da dove era uscito in scambio con l’H+.
Non superare i 60meq/h di KCl. I bicarbonati vanno somministrati per correggere l’acidosi che è deleteria per l’apparato cardiovascolare perché ha effetto inotropo negativo, riduce le resistenze periferiche, aumenta il ritorno venoso.
Nella CAD la dissociazione dell’Hb è normale per gli effetti opposti dell’acidosi (la favorisce) e della diminuzione del 2,3dpg (difosfoglicerato) che la diminuisce. Se l’acidosi viene compensata troppo rapidamente si ha solo l’aumento dell’affinità per l’O2 dato dalle basse concentrazioni di 2,3dpg e ciò può ridurre la cessione di ossigeno ai tessuti. Si possono infondere 50-100meq di bicarbonato in 500ml di soluzione.
SINDROME IPERGLICEMICA IPEROSMOLARE NON CHETOACIDOSICA
La sindrome iperglicemica iperosmolare non chetoacidosica (SIINC) è caratterizzata da una marcata iperglicemia (1000mg/100ml circa il doppio della CAD) con disidratazione ed iperosmolarità del plasma senza segni di chetoacidosi. Mancano vomito e nausea (costituiscono i segnali di allarme nella CAD) mentre è presente febbre anche senza infezioni (nella CAD la febbre è assente anche con infezioni).
Il meccanismo patogenico dell’iperosmolarità è chiaro:
- Osmolarità (mosm/L) = 2 x (K+ + Na+) + Glicemia/18 + Urea/2,8
Se la glicemia sale, sale anche l’osmolarità (valore normale 280mOsm/L), questo determina la disidratazione (poliuria osmotica). Meno chiaro è il meccanismo dell’assenza di chetoacidosi. Si ipotizza che i livelli di insulina sono più bassi di quelli necessari a controllare la glicemia, ma più alti di quelli necessari ad inibire la lipolisi. In effetti in molti casi di SIINC gli AGL sono più bassi che nella CAD.
La mortalità tende ad essere tanto più elevata quanto maggiore è l’osmolarità.
La sindrome si sviluppa in tempi più lunghi e la poliuria può anticipare di giorni o settimane l’esordio. Bisogna stare attenti a come somministrare l’insulina che può facilmente dar luogo ad edema cerebrale. Quando la glicemia scende a 250mg/100ml si inizia ad infondere glucosate al 5% ed insulina.
Una sindrome iperglicemica iperosmolare si può verificare anche nel DMT1 cui vengano somministrate dosi di insulina.
LE IPOGLICEMIE IATROGENE
Per ipoglicemia si intendono valori della glicemia inferiore a 45mg/100ml ematico e 50mg/100ml plasmatico. La caduta rapida della glicemia dà luogo a manifestazioni prevalentemente adrenergiche, invece, la discesa lenta e costante della glicemia dà luogo a manifestazioni prevalentemente a carico del SNC (neuroglicopenia). I farmaci che più frequentemente inducono ipoglicemia sono:
Insulina e ipoglicemizzanti orali:
- Eccesso di dosaggio da errore di lettura nella siringa, prescrizione, ecc…
- Ridotto fabbisogno insulinica
- Ridotto apporto calorico
- Esercizio muscolare
- Ritardato assorbimento degli ipoglicemizzanti orali per gastroparesi
- Assorbimento di cibo sfasato rispetto all’insulina per gastroparesi
- Ritardato assorbimento dell’insulina (sclerodermia)
- Altre malattie (ipopituitarismo, ipotiroidismo, insufficienza renale cronica)
- Guarigione da uno stato di stress medico, chirurgico o psichico
- Attivazione parasimpatica – fame, nausea, salivazione
- Sofferenza corticale lieve – astenia, cefalea, sonnolenza, senso di mancamento, irritabilità, parestesie, difficoltà di concentrazione
- Attivazione simpatica – sudorazione, tachicardia, pallore, iperpnea, tremori, midriasi, ipertensione
- Sofferenza corticale e sottocorticale – allucinazioni, crisi di riso o pianto, eccitazione, monoparesi, emiparesi, aprassie, afasia, stato confusionale, perdita di conoscenza
- Sofferenza mesencefalica – ipertono, iperreflesia, tetania, spasmi, deviazione dei bulbi oculari
- Sofferenza mielencefalica – coma profondo, ipotensione, miosi, iporeflesssia, ipotermia
- Ipoglicemia lieve – i sintomi neurogeni e autonomici vengono riconosciuti dal soggetto e trattati dall’assunzione orale di carboidrati, senza progressione della sintomatologia. In queste condizioni il paziente è consapevole e non ha bisogno di un’altra persona per curarsi
- Ipoglicemia severa – è quella condizione associata a convulsioni, stato soporoso, coma, per cui occorre l’intervento di un’altra persona per risolvere la crisi ipoglicemica. In questi casi la terapia si avvale del glucagone o dell’infusione endovena di soluzione glucosata.
l’ipoglicemia consapevole si ha quando sono presenti i segnali di allarme di cui abbiamo già parlato. L’inconsapevolezza della crisi ipoglicemica si ha quando gli ormoni della controregolazione (soprattutto l’adrenalina) sono insufficienti, per cui il paziente non si accorge dell’ipoglicemia e non corre ai ripari. Questi pazienti presentano una disfunzione autonomia. Non solo in questo caso i pazienti non riconoscono l’ipoglicemia, infatti anche le ipoglicemie infantili e notturne sono temibili in quanto non vengono riconosciute.
L’IPOGLICEMIA NEL BAMBINO
L’ipoglicemia grave è relativamente frequente nel bambino e possono determinare un ritardo mentale. I bambini più piccoli spesso non sono capaci di riconoscere i sintomi dell’ipoglicemia e quindi non sono capaci di reagire, né di comunicare il proprio malessere agli adulti.
La paura delle crisi ipoglicemiche nei genitori dei bambini diabetici è assai maggiore che negli adulti diabetici.
LE IPOGLICEMIE NOTTURNE
la notte è il periodo più lungo di digiuno e gli schemi di trattamento insulinico sono per la maggior parte imperfetti, quindi incapaci di fornire il livello ottimale di farmaco nelle diverse ore della notte. Le ipoglicemie lievi che insorgono nel corso della notte possono decorrere misconosciute.
Terapia delle ipoglicemie:
- assunzione di zuccheri semplici
- soluzione glucosata al 20-30%
- glucagone
- cortisonici
- somatostatina
LA DIETA
Nel 90% dei casi riesce da sola a tenere sotto controllo il DMT2.
OBIETTIVO 1: Quantitativo
Il controllo dell’apporto calorico deve essere rigoroso sia se il paziente è magro o obeso tenendo il body mass index (BMI) tra 18,5 – 29,4 Kg/m2
OBIETTIVO 2: Distributivo
La distribuzione dei pasti deve essere bilanciata e ad intervalli regolari in cinque pasti al giorno
OBIETTIVO 3: Qualitativo
Prevenire l’aterosclerosi è importante nel diabete dunque sarà necessaria una dieta equilibrata (glicidi 50%, lipidi 30%, protidi 20%) con un basso contenuto in colesterolo (minore di 300mg al giorno) tenendo il rapporto tra grassi insaturi e saturi a 1-1,5.
FABBISOGNO CALORICO NORMALE
Il fabbisogno calorico giornaliero si calcola: Peso corporeo in Kg x 22 tenendo conto che alle donne di età superiore a 50 anni vanno tolte 100 – 200 Kcal, agli uomini di età inferiore a 50 anni si aggiungono 100 – 200 Kcal, per chi pratica attività fisica si somma un 30 – 100% in più e per le donne in gravidanza e allattamento un surplus di 300 – 500 Kcal.
Inoltre si deve tener conto che nell’ipertrigliceridemia occorre ridurre la percentuale di glicidi al 35%, bisogna limitare il consumo di zuccheri semplici che vengono rapidamente assorbiti e che le fibre alimentari, che non vengono digerite, riducono l’assorbimento dei carboidrati.
ESERCIZIO FISICO
L’esercizio fisico riduce il fabbisogno di insulina aumentandone la velocità di assorbimento nei muscoli sottostanti la sede di iniezione. Va effettuato con regolarità, ma vanno evitati gli esercizi particolarmente intensi (agonismo) qualora ciò dovesse avvenire, occorre o ridurre la somministrazione di insulina oppure aumentare la quota calorica nella dieta.
L’INSULINA
Scoperta nel 1921 a Toronto da Frederick Banting e Charles Best è indispensabile nel DMT1 e può essere necessaria nel DMT2. In passato si aveva a disposizione solo insulina estratta dal pancreas animale (suino e bovino), mentre oggi abbiamo l’insulina umana prodotta dai batteri con tecniche di ingegneria genetica.
INSULINE A BREVE DURATA D’AZIONE: RAPIDE
HUMULIN R (LILLY), BIOINSULIN R (GUIDOTTI).
Il flacone va conservato in frigorifero (non in freezer), ma somministrate a temperatura ambiente. Queste coprono le necessità dei pasti.
- Insulina pronta (in soluzione acquosa)
- Aspetto limpido
- Latenza 1-2 ore
- Picco 2-4 ore
- Durata 5-7 ore
- Somministrare 15-30 min prima dei pasti
- Introdotta nel 1996
- Aspetto limpido
- Latenza mezz’ora
- Picco 1-2 ore
- Durata 3-5 ore
- Somministrare subito prima o subito dopo i pasti
Insulina NPH (Neutral Protamine Hegedorn)
- Aspetto torbido
- Picco 6-10 ore
- Durata 24-48 ore
- Simile alla precedente
- Insulina ultralenta
- Aspetto torbido
- Picco 18-24 ore
- Durata > 36 ore
SOMMINISTRAZIONE
La somministrazione può essere sottocutanea (addome e braccia assorbono più rapidamente di natiche e cosce) cambiando sistematicamente il punto di iniezione (per evitare le lipodistrofie) cercando di rimanere il più a lungo possibile nella stessa zona (per evitare la variabilità dei tempi di latenza).
La somministrazione può essere in vena e in flebo, ma solo per le insuline pronte e in modo frazionato.
La somministrazione può essere effettuata anche tramite dispositivi insulinici a penna (dispositivi a penna con cartucce da 100 e da 300 u) questi hanno il vantaggio di permettere il trasporto dell’insulina in tasca o in borsa e la possibilità di iniettarla senza doverla aspirare da una fiala.
La dose di insulina è regolata ruotando il cappuccio fino al punto corrispondente al dosaggio insulinico desiderato. Una volta inserito l’ago si preme il cappuccio.
GLI IPOGLICEMIZZANTI ORALI
SULFANILUREE
Queste sono compresse che se prese stimolano la secrezione di insulina, potenziandone l’azione e inibiscono la secrezione di glucagone, la glucogenolisi, la lipolisi e la chetogenesi.
- TOLBUTAMIDE
- GLIBENCLAMIDE
- GLICIZIDE
- CLORPOPAMIDE
Questi ipoglicemizzanti orali non stimolano la secrezione di insulina, ma riducono l’assorbimento intestinale di glucosio. Inibiscono la gluconeogenesi epatica potenziando l’azione dell’insulina, hanno azione fibrinolitica.
La METFORMINA dà meno frequentemente acidosi lattica e si usano soprattutto in pazienti in sovrappeso.
- FENFORMINA
- FENFORMINA
- BUFORMINA
Le dislipidemie sono disturbi del metabolismo lipidico derivanti dall’accelerata sintesi o da un diminuito catabolismo delle lipoproteine vettrici del colesterolo e dei trigliceridi. L’importanza clinica è dovuta agli effetti delle iperlipidemie, aterosclerosi e pancreatite, due malattie pericolose per la vita.

La maggior parte dei grassi provenienti dalla dieta sono trigliceridi o esteri di glicerolo a catena lunga composti da acidi grassi saturi (Acido Palmitico, Acido Stearico) o insaturi.
Se i tre acidi grassi sono uguali si parla di trigliceridi semplici, se sono diversi di trigliceridi misti.
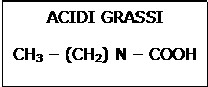 Gli acidi grassi sono costituiti da catene alifatiche di diversa lunghezza con funzione carbossilica finale.
Gli acidi grassi sono costituiti da catene alifatiche di diversa lunghezza con funzione carbossilica finale. Dopo la scissione del legame estere ad opera di una lipasi, gli acidi grassi subiscono la beta ossidazione.

Il pancreas produce la lipasi che rompe il legame estere dei trigliceridi, successivamente dopo l’assorbimento gli acidi grassi vengono esterificati di nuovo ed aggregati in chilomicroni.
FISIOLOGIA
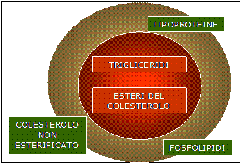 Il trasporto nel sangue dei lipidi avviene grazie a lipoproteine, che presentano una parte centrale, lipidica lipofila ed idrofobica costituita prevalentemente da trigliceridi ed esteri del colesterolo, una parte esterna a contatto con l’acqua composta da fosfolipidi disposti con le teste polari verso l’esterno, colesterolo libero e lipoproteine con struttura anfipatica, cioè una parte idrofila ed una liofila.
Il trasporto nel sangue dei lipidi avviene grazie a lipoproteine, che presentano una parte centrale, lipidica lipofila ed idrofobica costituita prevalentemente da trigliceridi ed esteri del colesterolo, una parte esterna a contatto con l’acqua composta da fosfolipidi disposti con le teste polari verso l’esterno, colesterolo libero e lipoproteine con struttura anfipatica, cioè una parte idrofila ed una liofila. I chilomicroni sono molto ricchi in trigliceridi esogeni, le VLDL in trigliceridi endogeni, le LDL in colesterolo.
CLASSIFICAZIONE DELLE LIPOPROTEINE
| ELETTROFORESI | PRINCIPALI LIPOPROTEINE | |
| CHILOMICRONI | origine | AI AII,AIV, B48,CI,CII,CIII, E |
| VLDL | pre-beta | B100, CI,CII,CIII, E |
| IDL | pre-pre-beta | B100, CI,CII,CIII, E |
| LDL | beta | B100 |
| HDL2 | alfa | AI,AII, CI,CII,CIII, D |
| HDL3 | alfa | AI,AII, CI,CII,CIII, D |
Chilomicroni: AI,AII,AIV, B48,CI,CII,CIII, E
Dopo il pranzo, in seguito all’assorbimento intestinale dei grassi si ha una notevole quantità di chilomicroni in circolo. Questi sono inizialmente privi di APO E ed APO C che ricevono scambiando fosfolipidi con le HDL.
L’APO CII attiva la LPL (lipoproteinlipasi endogena) che idrolizza circa il 90% dei trigliceridi presenti nei chilomicroni (l’APO CIII invece la inibisce) perciò i soggetti con deficit genetico di APO CII o di LPL presentano alta ipertrigliceridemia, anche dopo un pasto normale, questo può causare pancreatite acuta, ma non aterosclerosi precoce.
Dopo l’idrolisi e la liberazione dei trigliceridi dai chilomicroni questi perdono l’affinità per la LPL e circolando come chilomicroni remnants.
A questo punto la particella, più piccola e ricca in APO B48 e colesterolo esterificato, raggiunge il fegato legandosi all’epatocita.
LIPIDOGENESI ENDOGENA
 Il fegato trasforma i carboidrati della dieta in eccesso in Acidi grassi che lega al glicerolo (trigliceridi), questi vengono assemblati come VLDL e trasportati dal fegato alla periferia. Qui subiscono, come i chilomicroni, l’azione della LPL endoteliale (idrolisi parziale dei trigliceridi) e ricevono dalle HDL colesterolo esterificato (ad opera della LCAT – lecitina colesterolo acil transferasi) per sopperire alla mancanza nel nucleo dei trigliceridi idrolizzati.
Il fegato trasforma i carboidrati della dieta in eccesso in Acidi grassi che lega al glicerolo (trigliceridi), questi vengono assemblati come VLDL e trasportati dal fegato alla periferia. Qui subiscono, come i chilomicroni, l’azione della LPL endoteliale (idrolisi parziale dei trigliceridi) e ricevono dalle HDL colesterolo esterificato (ad opera della LCAT – lecitina colesterolo acil transferasi) per sopperire alla mancanza nel nucleo dei trigliceridi idrolizzati. Quasi tutte le VLDL ricevendo colesterolo esterificato danno origine alle LDL (catabolizzate dai tessuti extraepatici) mentre i remnants dei chilomicroni e delle VLDL stesse vengono catabolizzati dal fegato.
Una funzione delle LDL è fornire un apporto costante di colesterolo ai vari organi (corteccia surrenale, linfociti, ecc…), questo viene garantito da un sistema che espone i recettori per le LDL in modo inversamente proporzionale alla sua concentrazione.
L’eccesso di colesterolo circolante viene trasformato dai macrofagi nelle cellule schiumose tipiche dell’ateroma (soprattutto per le LDL ossidate).
LDL
Si legano prevalentemente ai recettori cellulari ad alta affinità per le LDL la cui concentrazione è inversamente proporzionale a quella della LDL circolanti, in modo da garantire un apporto costante di colesterolo alle cellule.
I recettori hanno affinità elettiva per le APO B100
Le cellule in eccesso possono essere fagocitate dai macrofagi con accumulo di colesterolo nelle cellule periferiche, queste formano le cellule schiumose della placca ateromasica. In genere si tratta di LDL ossidato perché quello non ossidato non viene captato dai macrofagi.
HDL
Le HDL rappresentano un deposito per la LPL e la LCAT che permette il catabolismo delle VLDL in LDL. Le LDL assumono il colesterolo ove la LCAT lo esterifica, quindi le HDL portando il colesterolo esterificato al fegato ove viene usato per la costruzione di acidi biliari, proteggono le arterie dall’aterosclerosi. Si ritiene questo trasporto del colesterolo dai tessuti periferici al fegato sia il principale meccanismo con cui le HDL proteggono le arterie dall’aterosclerosi.
Bassi livelli plasmatici di HDL favoriscono dunque l’aterosclerosi.
Le cause di bassi livelli plasmatici di HDL sono cause genetiche o condizioni associate (ipertrigliceridemia, aumento delle VLDL), mentre le condizioni o le sostanze che aumentano le HDL sono l’esercizio fisico, il digiuno, l’assunzione di piccole dosi di alcool e statine.
CLASSIFICAZIONE DELLE DISLIPIDEMIE PRIMITIVE
| TIPO I | Chilomicroni | Trigliceridi | Deficit LPL, APO CII |
| TIPO II A | Beta LP LDL | Colesterolo | Deficit APO B |
| TIPO II B | Beta e pre-beta LDL e VLDL | Colesterolo e Trigliceridi | Autonoma dominante |
| TIPO III | Remnants | Deficit APO EIII | |
| TIPI IV | Pre beta VLDL | Trigliceridi | Autonoma dominante |
Il tipo I (iperchilomicronemia familiare) è dovuto a deficit di LPL o APO CII. Compare nei primi anni di vita, ha decorso benigno e la sintomatologia si attenua con gli anni.
Si riscontrano:
- Xantomi eruttivi.
- Siero lattescente fino a 48 ore dopo il pasto.
- Lipemia retinalis, cioè colorazione rosea dei vasi retinici.
- Episodi di pancreatite acuta per l’occlusione dei capillari pancreatici con necrosi focale delle cellule acinose e fuoriuscita di enzimi ed autolisi.
- Coliche addominali per distensione della glissoniana, diarrea, distensione delle anse intestinali.
Il tipo II (ipercolesterolemia famigliare) è dovuto ad un difetto della sintesi del recettore per l’LDL. Compare in età giovanile e pochi sopravvivono ai 30 anni.
Si riscontrano:
- Ipercolesterolemia imponente
- Xantomi cutanei, tendinei (per aumentata produzione di cellule spazzine)
- Gerontoxon (arco corneale lipidico presente inizialmente solo sul bordo inferiore della cornea, poi circolare)
- Angine ed infarti
- Aterosclerosi (infiltrazioni di LDL nell’endotelio dei vasi con accelerazione dell’aggregazione piastrinica a livello della placca)
Il tipo IV è caratterizzato da valori elevati di trigliceridi e si ha maggiore frequenza di eventi cardiovascolari.
LE IPERLIPEMIE SECONDARIE
DIABETE MELLITO
Si ha iperchilomicronemia (tipo I) nella chetoacidosi perché il deficit di insulina impedisce l’attivazione della LPL responsabile della idrolisi dei chilomicroni.
Si ha l’aumento delle VLDL per eccesso di produzione epatica dovuto all’aumentato trasporto al fegato di acidi grassi liberi.
Si ha ipertrigliceridemia nei casi di insulinoresistenza e aumento delle LDL per riduzione dei recettori e riduzione delle HDL.
INSUFFICIENZA RENALE CRONICA
Si ha l’aumento delle VLDL per svariati fattori e la diminuzione delle HDL.
COLOSTASI CON FUNZIONE EPATICA PROTIDOSINTETICA CONSERVATA
Si ha l’aumento della IPX (simile alle LDL, ma manca dell’APO B) che si forma per reflusso di bile nel torrente circolatorio.
ALCOLISMO CRONICO
Aumento delle VLDL per accumulo degli acidi grassi liberi dovuti all’inibizione della beta ossidazione.
TERAPIA
- Dieta
- Farmaci
o Acido Nicotinico
o Resine a scambio ionico
o Statine
o Olio di pesce - esteri degli Acidi Omega-3
FIBRATI (BEZOFIBRATO, GEMFIBROZIL)
La loro principale azione è ridurre i trigliceridi, ma riducono anche il colesterolo LDL ed aumentano l’HDL.
RESINE A SCAMBIO IONICO (COLESTIRAMINA)
Agiscono legandosi agli Acidi biliari e prevenendone il riassorbimento, aumentano i recettori epatici per le LDL favorendo la riduzione del colesterolo. Possono dare ipertrigliceridemia ed interferire con l’assorbimento delle vitamine liposolubili. somm. 12 – 14 gr/die
STATINE (ATORVASTATINA, PRAVASTATINA, SINVASTATINA)
Inibiscono in modo competitivo la produzione di colesterolo.
Sono utili anche nella prevenzione della cardiopatia ischemica (riducono il rischio del 25%) e non vanno associati ai fibrati per il rischio di gravi episodi di rabdomiolisi, soprattutto nei pazienti con insufficienza renale.



Nessun commento:
Posta un commento