 CARENZA CONGENITA DI ALFA 1 ANTITRIPSINA
CARENZA CONGENITA DI ALFA 1 ANTITRIPSINA
Codice esenzione : RC0200
Deficienza della proteasi inibitrice alfa1-antitripsina responsabile della degradazione dell'elastina delle cellule alveolari e di altre proteine strutturali di altri tessuti. -Medline Thesaurus
Vengono osservati due tipi di malattie. Un disturbo epatico caratterizzato da inclusioni epatiche a causa della tendenza dell'alfa1-antitripsina (Z) di autoaggregarsi. E' caratterizzato da epatomegalia e cirrosi. La deficienza di alfa1-antitripsina porta ad uno squilibrio tra proteasi e inibizione di proteasi nel polmone, favorendo la distruzione della parete alveolare. Ne risulta una malattia polmonare
ostruttiva, che e la manifestazione clinica prevalente della carenza congenita di alfa1-antitripsina. I campi polmonari maggiormente affetti sono le regioni basali (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
Enfisema, cisti polmonare, sintomi di asma o bronchite cronica. "Sindrome dell'epatite neonatale": iperbilirubinemia, aumento delle transaminasi, frequentemente con epatosplenomegalia. Malattia epatica epatocellulare, ittero, inclusioni epatiche intra citoplasmatiche, epatomegalia (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
La carenza congenita di alfa1-antitripsina colpisce 1 ogni 1.600-1.800 dei nati vivi, ma studi prospettivi sulla storia naturale indicano che solamente il 10-15% della popolazione affetta sviluppa una malattia polmonare clinicamente significativa. Un numero sostanziale di individui affetti sviluppano una malattia polmonare distruttiva e un enfisema all'inizio della terza decade di vita. Il fumo di sigaretta aumenta notevolmente il tasso e la severità della malattia polmonare (Wyllie/Hyams, Pediatric Gastrointestinal Disease, Second Edition).
La malattia ostruttiva polmonare e la manifestazione clinica prevalente della carenza congenita di alfa1-antitripsina. Le regioni basali sono quelle colpite piu severamente. Nei non-fumatori, la dispnea si manifesta ad un'età media dai 45 ai 50 anni, e nei fumatori a circa 35 anni d'età. I fumatori mostrano un tasso maggiore di distruzione polmonare e hanno una sopravvivenza minore dei non fumatori affetti. Il fumo ha un effetto maggiore nel condizionare sia l'età di comparsa dei sintomi polmonari sia il decorso della malattia. I sintomi di disturbi epatici durante l'infanzia sono presenti in circa il 17 per cento di tutti gli affetti da carenza congenita di alfa1-antitripsina. Solo un apiccola percentuale di tutti i pazienti con la mallattia, dopo la comparsa dei sintomi epatici, hanno una cattiva prognosi. Altri fattori familiari possono influenzare la prognosi (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
L'alfa1-antitripsina e una serina-proteasi sierica che inibisce un largo spettro di proteasi sieriche. Il maggior substrato fisiologico e l'elastasi, soprattutto nel basso tratto respiratorio. L'alfa1-antitripsina ha un ruolo importante nel difendere i tessuti dalla proteolisi, grazie alla sua efficienza di inibizione, l'estesa specificità di substrato ed il facile accesso ai tessuti. L'alfa1-antitripsina e sintetizzata soprattutto dalle cellule parenchimali del fegato, ma anche dal rene e dall'intestino.
Il locus (Pi locus) per l'alfa1-antitripsina e nel cromosoma 14 in 14q32.1 ed in un cluster di geni che include la globulina legante il corticosteroide e l'inibitrice della proteina C.
L'ereditarietà e descritta come combinante, poiché l'espressione di entrambi gli alleli possono essere osservati negli eterozigoti attraverso diverse tecniche elettroforetiche.
L'alfa1-antitripsina mostra una grande variabilità genetica, presenta più di 70 varianti genetiche, molti delle quali sono state sequenziate. La gran parte delle varianti sono associate ad una produzione normale (quantitativa e qualitativa) di alfa1-antitripsina.
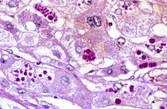
In tutte le popolazioni, Pi*M e l'allele piu comune. L'allele Pi*Z e la variante più frequente. La maggior parte degli individui con carenza congenita di alfa1-antitripsina sono di tipo PiZZ. Gli omozigoti per Pi ZZ presentano una concentrazione plasmatica di alfa1-antitripsina corrispondente al 15-20% di quello normale assieme ad una corrispondente concentrazione ridotta nel liquido di lavaggio bronco alveolare. La carenza e dovuta alla mancanza di secrezione di Z alfa1-antitripsina dall'epatocita, dove si formano inclusioni nel reticolo endoplasmico (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
La carenza congenita di alfa1-antitripsina deve essere considerata nella diagnosi differenziale di pazienti con enfisema, ittero, malattia epatica in infanzia ed in età adulta (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
La diagnosi di carenza congenita di alfa1-antitripsina si basa sul fenotipo della proteina (alfa1-antitripsina) presente nel siero del paziente, determinato con l'isoelectric focusing o con l'elettroforesi su agarosio a pH acido. La determinazione della concentrazione di alfa1-antitripsina nel siero non rappresenta l'unica base di diagnosi, poiché l'alfa1-antitripsina e una proteina di fase acuta, quindi puo essere temporaneamente elevata nei pazienti piZZ durante la risposta dell'ospite all'infiammazione tissutale. La diagnosi di carenza di alfa1-antitripsina PiZZ puo essere caratterizzata dalle evidenze istologiche positive, per reazione all'acido periodico di Schiff, quali globuli diastasi-resistenti nel reticolo endoplasmico degli epatociti. La biopsia epatica puo portare ad un riscontro di colestasi, necrosi epatocellulare, infiltrato infiammatorio cellulare, distruzione delle cellule epiteliali dei dotti, fibrosi peri portale o cirrosi (Wyllie/Hyams, Pediatric Gastrointestinal Disease, Second Edition).
Diagnosi prenatale e prevenzione
La diagnosi prenatale può essere fatta usando la PCR, sia con sonde di oligonuclotidi sintetici, sia con digestione con enzimi di restrizione. La sorgente di DNA fetale possono essere amniociti o villi coriali. La tipizzazione del Pi esatto (inibotore della proteasi) e un primo passo cruciale nella diagnosi prenatale per determinare se entrambi i genitori abbiamo l'allele Z , se non siano deficienti, se l'allele nullo sia presente in entrambi i genitori (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
1. Terapia per la prevenzione della malattia polmonare. La terapia più efficace per la compromissione polmonare della carenza congenita di alfa1-antitripsina sta nella prevenzione, anche attraverso l'evitare il fumo di sigaretta. In questi individui, che dimostrano segni di compromissione relativamente precoci, l'entità della compromissione può essere rallentata ripristinando il bilancio polmonare dell'inibitore della proteasi attraverso la somministrazione di adatti inibitori delle proteasi.
2. Terapia sostitutiva.
a. Terapia infusionale. Il trattamento attuale più promettente della carenza congenita di alfa1-antitripsina e la somministrazione di alfa1-antitripsina purificata a partire da plasma umano, per infusione settimanale o mensile.
b. Terapia per aerosol. Poiché i polmoni sono nella maggior parte dei casi il solo organo principale significatamente danneggiato dalla degradazione dell'elastasi, un efficiente approccio terapeutico e immettere l'alfa1-antitripsina direttamente nel polmone.
c. Terapia sostitutiva con alfa1-antitripsina ricombinante. L'alfa1-antitripsina umana normale e stata prodotta in alta quantità nell'Escherichia Coli e nel lievito. Un interessante possibilità per produrre una larga quantità di alfa1-antitripsina necessaria per la terapia sostitutiva e di usare animali transgenici.
3. Terapia genica. La carenza congenita di alfa1-antitripsina può costituire un utile modello per testare vari tipi di terapia genica. Tuttavia, in termini concreti, gli approcci molto più semplici della terapia infusiva di alfa1-antitripsina o della somministrazione per aerosol, associati o no alla terapia antiossidante possono essere considerati più fattibili e con più vantaggioso rapporto costo/efficacia.
4. Trapianto del polmone. E' divenuto un trattamento fattibile in pazienti selezionati con uno stadio terminale della malattia polmonare.
5. Shunt porto-cava, trapianto del fegato. Il primo e indicato in alcuni bambini con cirrosi e sanguinamenti gastro-intestinali ricorrenti, il secondo in caso di avanzata malattia epatica (C. Scriver et al., The Metabolic and Molecular Bases of Inherited Disease, Seventh Edition).
Hill-AT; Bayley-DL; Campbell-EJ; Hill-SL; Stockley-RA
Airways inflammation in chronic bronchitis: the effects of smoking and alpha1-antitrypsin deficiency
Eur-Respir-J. 2000 May; 15(5): 886-90
Durr-R; Caselmann-WH
Carcinogenesis of primary liver malignancies.
Langenbecks-Arch-Surg. 2000 Apr; 385(3): 154-61
Hill-AT; Bayley-DL; Campbell-EJ; Hill-SL; Stockley-RA
Airways inflammation in chronic bronchitis: the effects of smoking and alpha1-antitrypsin deficiency.
Eur-Respir-J. 2000 May; 15(5): 886-90
Lomas-DA
Loop-sheet polymerization: the mechanism of alpha1-antitrypsin deficiency.
Respir-Med. 2000 Aug; 94 Suppl C: S3-6
Campbell-EJ
Alpha1-antitrypsin deficiency: incidence and detection program.
Respir-Med. 2000 Aug; 94 Suppl C: S18-21
Miravitlles-M
Alpha1-antitrypsin deficiency: epidemiology and prevalence.
Respir-Med. 2000 Aug; 94 Suppl C: S12-5
Moustafellos-E; Illueca-M; Remotti-HE; Auld-PA; Hanauske-Abel-HM
Objective ranking of fibrosis in standard histologic sections of human neonatal liver: applicability to alpha1-antitrypsin deficiency.
J-Pediatr-Gastroenterol-Nutr. 2000 May; 30(5): 503-8
Sveger-T; Thelin-T
A future for neonatal alpha1-antitrypsin screening?
Acta-Paediatr. 2000 Mar; 89(3): 259-61
Scharnweber-K
Alpha 1-antitrypsin deficiency and the impact of nursing interventions and treatment with intravenous therapy. An overview.
J-Intraven-Nurs. 1999 Sep-Oct; 22(5): 258-64
Yang-P; Tremaine-WJ; Meyer-RL; Prakash-UB
Alpha1-antitrypsin deficiency and inflammatory bowel diseases.
Mayo-Clin-Proc. 2000 May; 75(5): 450-5
FONTE: http://malattierare.regione.veneto.it/

Nessun commento:
Posta un commento